服务热线
0771-3370160
近日,国家药监局关于发布仿制药参比制剂目录(第二十八批)的通告(2020年第35号)。目录中包括39种药物(含不同剂型)的参比制剂。这就意味着这些有参比制剂的品类的相关仿制药项目可以启动注册审批。
因此,从这次批准的参比制剂中可以看出:按照功效作用来看,抗感染类药物所占数量较多,为22%,除去剂量不同的相同品种占25%。
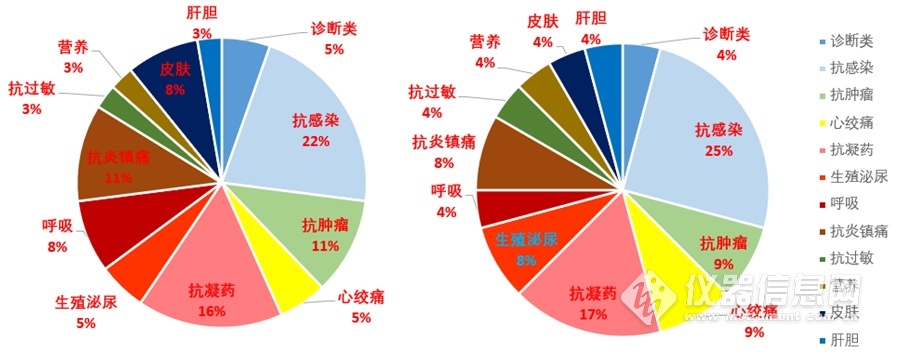
图为不同功效的药物所占的比例(右侧是合并同种药物不同剂型的统计)
按照剂型来看,注射剂最多(占41%),其次是片剂(占33%)。
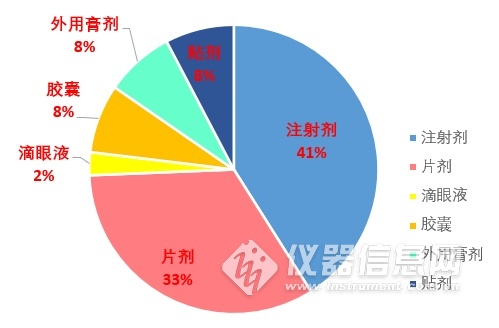
图为不同剂型所占的比例
来自美国的药品占44%,近一半;来自欧洲的有36%,还有两种来自日本的原研药。值得注意的是,已经有14%的药品是已经进口至国内使用的,如日本电工Tulobuterol Patch妥洛特罗贴剂Amiaid(阿米迪)。
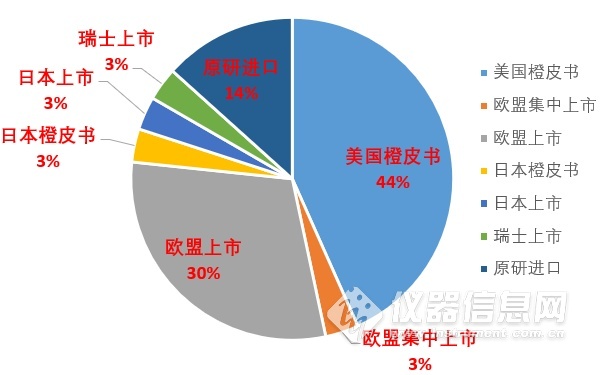
图为不同来源药物所占的比例
仿制药参比制剂是做生物等效性(BE)研究的参照品。为规范仿制药审评和一致性评价工作,优化工作程序,强化服务指导,保证公平、公正、公开,化学仿制药参比制剂需要通过遴选产生。参比制剂遴选应以为公众提供高质量的仿制药品为目标。
遴选步骤和遵循的原则如下:
(1)原研药品选择顺序依次为:国内上市的原研药品、经审核确定的国外原研企业在中国境内生产或经技术转移生产的药品、未进口原研药品。原研药品是指境内外首个获准上市,且具有完整和充分的安全性、有效性数据作为上市依据的药品。
(2)在原研药品停止生产或因质量等原因所致原研药品不适合作为参比制剂的情况下,可选择在美国、日本或欧盟等管理规范的国家获准上市的国际公认的同种药品、经审核确定的在中国境内生产或经技术转移生产的国际公认的同种药品。国际公认的同种药物是指在美国、日本或欧盟等获准上市并获得参比制剂地位的仿制药。
(3)其他经国家药品监督管理局评估确定具有安全性、有效性和质量可控性的药品。
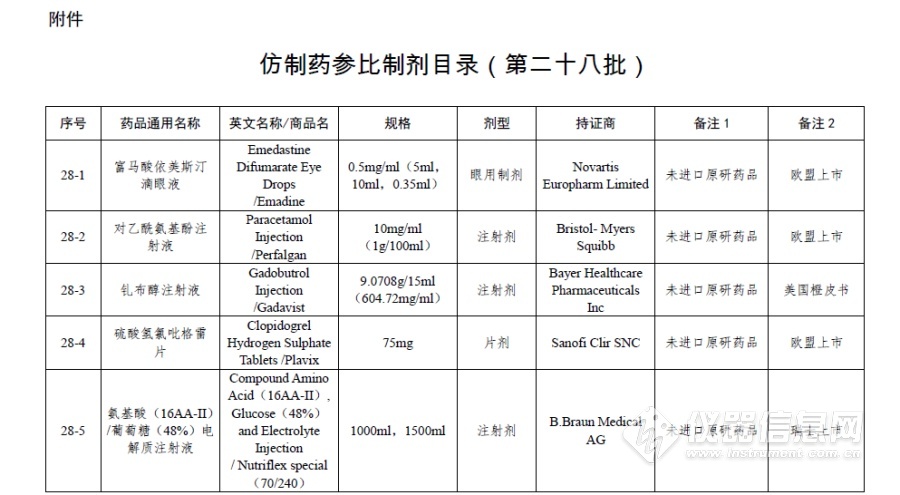
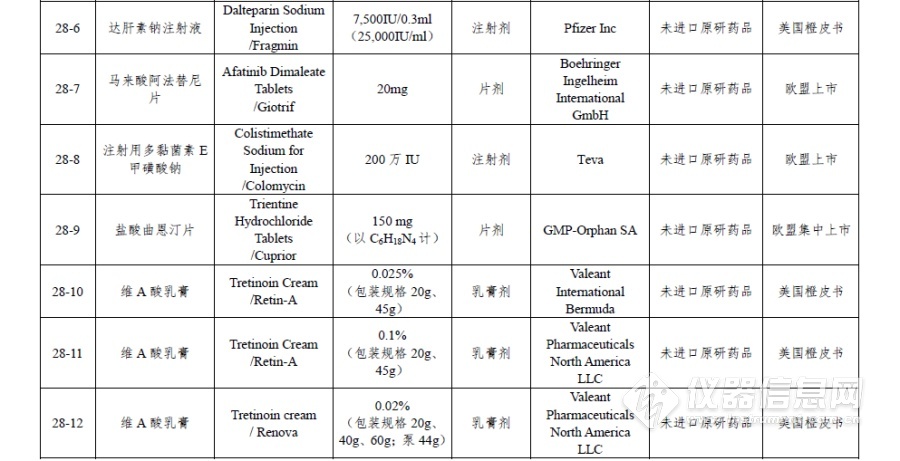
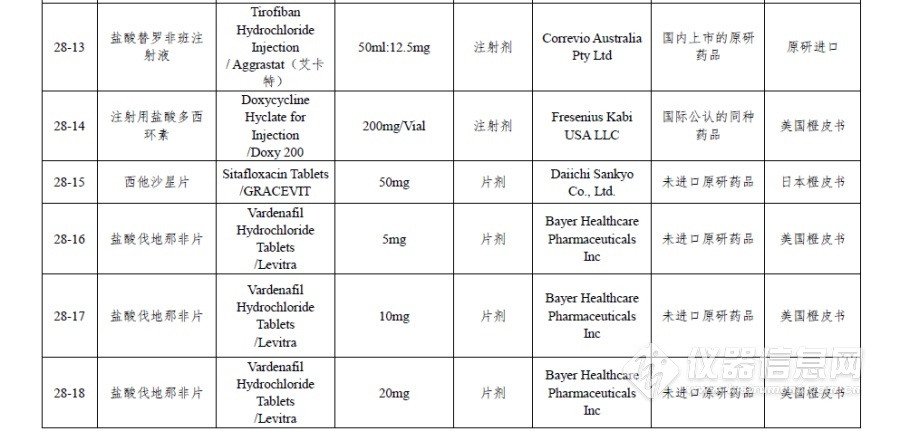
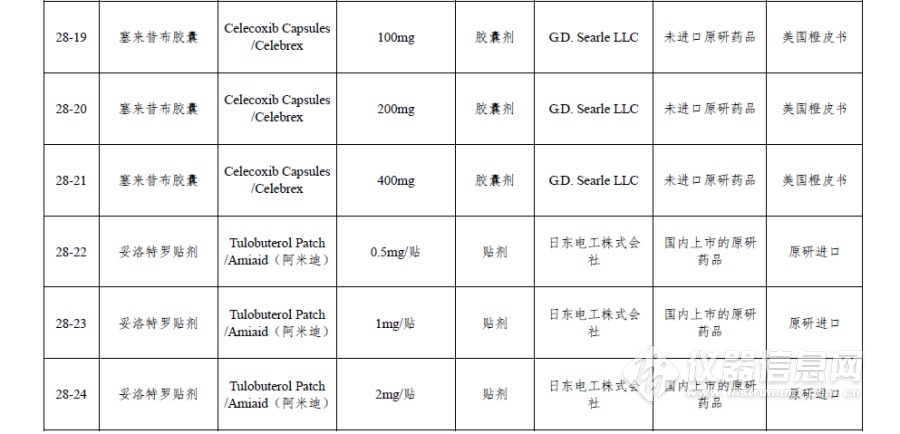
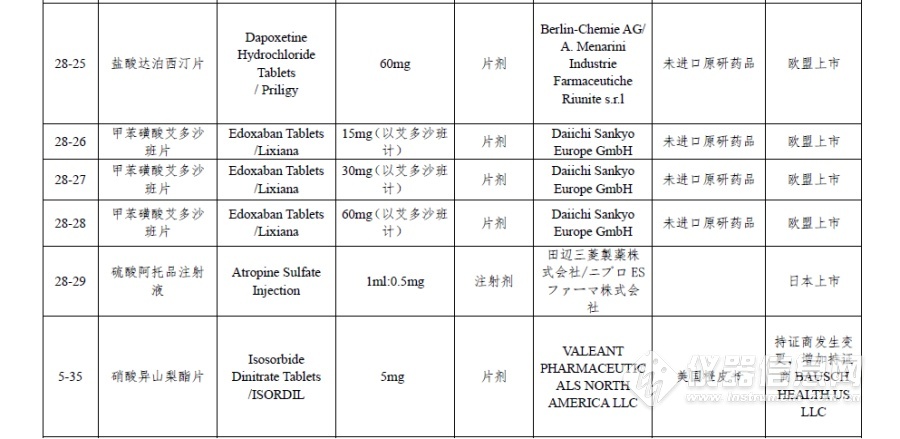
附件:仿制药参比制剂目录(第二十八批)
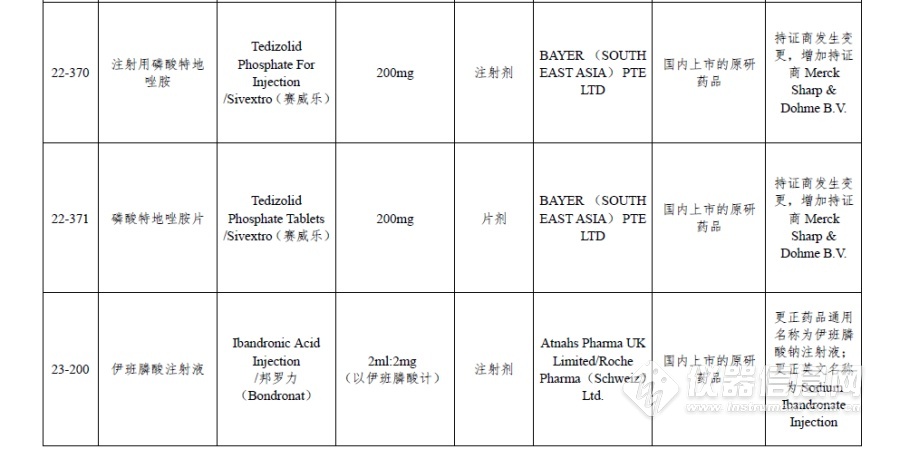
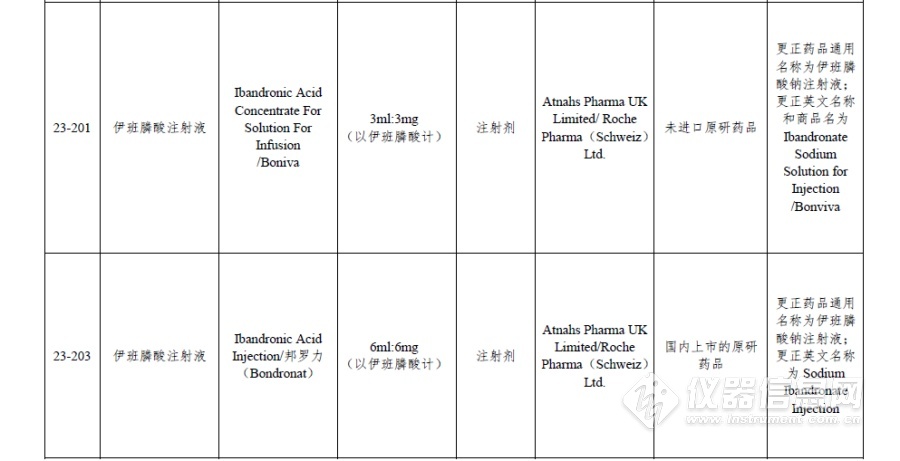
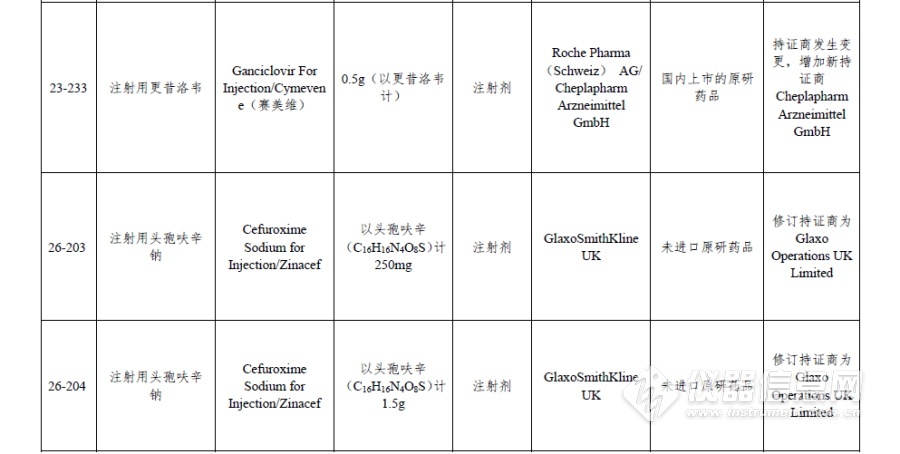
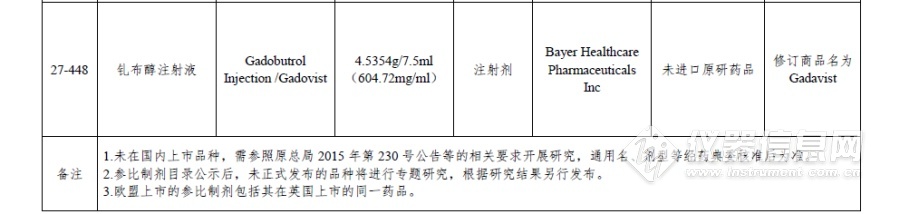
[来源:仪器信息网]
声明:转载此文是出于传递更多信息之目的。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。
武汉会战刚刚结束不久,牡丹江战疫又要打响。 黑龙江省牡丹江市将成为继武汉后全国第二个进行如此大规模全民核酸检测的城市。 从官方媒体的报道获悉,从5月14日0时至6月1日24时,

日前,自然资源部公布第三批已废止或者失效的规范性文件目录,废止18件矿产资源管理规范性文件。据悉,这是为了保障矿产资源管理改革顺利推进而开展的专项清理,也是自然资源部贯彻落实党中央